Условия протекания, что провоцирует
Факторы, влияющие на скорость протекания химических реакций:
- природа веществ, вступающих в реакцию (например, натрий активно реагирует с водой с воспламенением, а кальций спокойно);
- концентрация исходных веществ (например, цинк с концентрированной соляной кислотой будет реагировать быстрее, чем с разбавленной);
- температура (с повышением температуры скорость большинства химических реакций возрастает);
- давление для реакций с участием газообразных веществ (увеличение давления приводит к возрастанию скорости реакции);
- наличие катализатора (катализаторы ускоряют химические реакции);
- поверхность соприкосновения реагирующих веществ (измельченные порошкообразные вещества реагируют быстрее, чем вещества в форме крупных кусков);
- характер растворителя;
- световое облучение, ионизирующее излучение и пр. (инициируют или ускоряют протекание реакций).
Зависимость скорости от концентрации веществ в растворах (смесях), вступающих во взаимодействие, изучалась учеными с XIX века. Норвежцы К.Гульдберг и П. Вааге (1867 г.) открыли кинетический закон действующих масс для простых реакций (протекающих в одну стадию). Он формулируется следующим образом:
для реакции aA + bB = cC
v = kAaBb
k — коэффициент пропорциональности, константа скорости реакции.
Влияние температуры на скорость реакции связано с понятием энергии активации — это избыточная энергия, которую должна приобрести частица, чтобы вступить в химическую реакцию. С повышением температуры возрастает доля частиц, обладающих энергией, значение которой превышает пороговую величину энергии активации. Поэтому большее число частиц вступает в химическую реакцию, скорость реакции возрастает.
На скорость протекания реакций в газообразном состоянии влияет давление. Увеличение давления p аналогично уменьшению объема V, так как эти величины обратно пропорциональны. Эту зависимость выражает уравнение Менделеева-Клайперона:
pV=nRT
p — давление
V — объем
n — количество вещества
R — универсальная газовая постоянная
T — температура
Поскольку концентрация
с = n⁄V
возрастает с уменьшением объема, то увеличение давления аналогично повышению концентрации. При повышении давления скорость химической реакции возрастает.
Действенным решением для увеличения скорости реакции является применение катализатора. Он увеличивает скорость реакции, при этом сам в процессе реакции не расходуется, его количество и состав остаются без изменения. Примерную схему реакции с участием катализатора представляют так:
A+K=AK (без катализатора)
AK+B=AB+K (с участием катализатора К),
где К — катализатор, А и В — вступающие во взаимодействие вещества.
Существуют гомогенный и гетерогенный катализ. При гомогенном катализе катализатор находится в том же агрегатном состоянии, что и исходные вещества. При гетерогенном катализе катализатор и исходные веществ находятся в разных агрегатных состояниях.
Биохимические реакции, протекающие в организме животных и человека, протекают с участием естественных катализаторов — ферментов. Их действие очень специфично и зависит от состояния здоровья органов и систем. Ферменты обладают высокой чувствительностью к кислотности внутренней среды, гипертермии, воздействию ряда медикаментозных средств и т.п.
Химическая реакция — что это такое
Когда говорят, что происходит химическая реакция, значит, что при взаимодействии двух веществ образуются другие, обладающие своими характерными свойствами. Эти свойства обуславливаются перегруппировкой атомов, в связи с чем разрушаются старые и формируются новые химические связи. Взаимодействие может происходить произвольно при контакте двух веществ, при нагревании (либо охлаждении), изменении давления, воздействии электрического тока, ионизации, радиационных процессов и т.п. Скорость реакций зависит от исходной концентрации реагентов, а также условий окружающей среды. Активация может происходить с помощью катализаторов либо физических факторов.
Согласно Закону сохранения материи (массы и энергии), в ходе химической реакции не происходит создание новой либо уничтожение существующей материи. Однако те компоненты, которые образовались, могут значительно отличаться по своим свойствам.
Для описания химических реакций используют химические уравнения , т.е. запись химической реакции с помощью определенных знаков и символов. Поскольку в ходе химических реакций атомы не исчезают и не возникают вновь, количество атомов одного элемента до и после реакции должно быть одинаковым. Для уравнивания числа атомов в уравнении используют специальные множители — коэффициенты, которые записывают перед формулами веществ.
Например, дана схема реакции (схемой называют запись химической реакции, в которой число атомов всех элементов до и после реакции не уравнено):
H2+O2→H2O
В формулах данного уравнения с левой стороны атомов кислорода больше, чем с правой (2 атома и 1 атом соответственно). Следовательно, его нужно сбалансировать с помощью коэффициентов. Правильный вид будет: 2H2+O2→2H2O
На практике определить, что прошла химическая реакция, можно по следующим признакам:
- изменение цвета;
- образование или исчезновение осадка;
- выделение газообразных продуктов реакции;
- выделение света;
- выделение или поглощение тепла.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции, когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например, изомеризация бутана в 2-метилпропан (изобутан):
CH3-CH2-CH2-CH3 → CH3-CH(CH3)-CH3.
2. Реакции, протекающие с изменением состава
Реакции соединения (A + B + … → D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. В неорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения. Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.
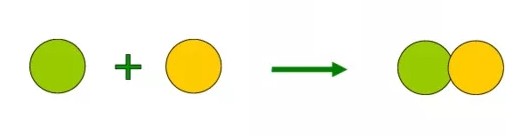
Например, гидратация :
CH2=CH2 + H2O → CH3-CH2-OH
Реакции разложения (A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.
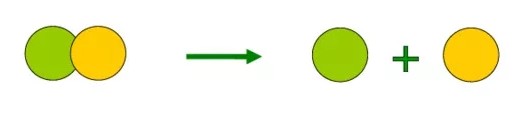
Например, при разложении пероксида водорода:
2H2O2 → 2H2O + O2.
В органической химии разделяют собственно реакции разложения и реакции отщепления. Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например, реакция отщепления водорода (дегидрирование) от пропана:
C3H8 → C3H6 + H2
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
Например, реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
C4H10 → C2H4 + C2H6
Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B.
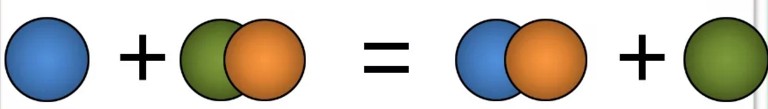
Например, более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например, при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
Na2CO3 + SiO2 → Na2SiO3 + CO2
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например, реакция хлорирования метана:
CH4 + Cl2 → CH3Cl + HCl
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD
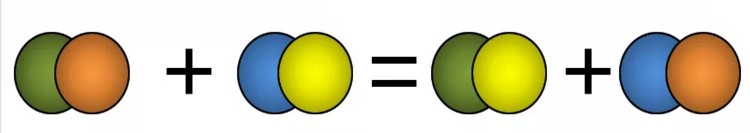
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
CH3-CH2-Cl + KOH = CH3-CH2-OH + KCl
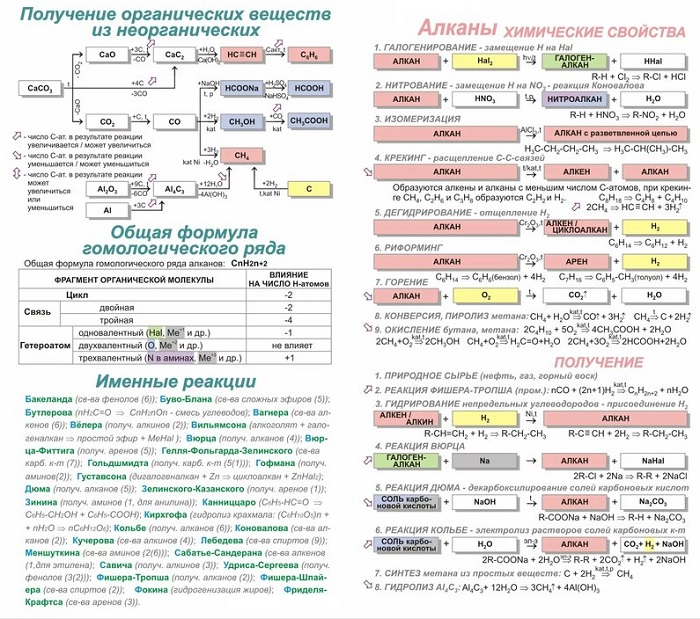
Именные реакции в органической химии для подготовки к ЕГЭ
Абитуриенту, поступающему на химический факультет, необходимо знать ряд именных реакций. Далее рассмотрим таблицу всех необходимых реакций для подготовки к сдаче ЕГЭ.
https://youtube.com/watch?v=oM9BKMULKoQ
Реакция Вюрца
Основана на методе, в котором проходит синтез симметричных насыщенных углеводородов, в которых воздействует металлический натрий на моногалогенопроизводные углеводородов (чаще всего разновидность бромидов или иодидов). В результате получаем удвоенный углеродный скелет.
Реакция считается подходящей для получения симметричных алканов:
2CH3 CH2 Br + 2Na = CH3
CH2 CH2 CH3 + 2NaBr.
Реакция Вюрца-Фиттига
Разновидностью предыдущей реакции считается реакция Вюрца-Фиттига, в результате которой образуются ароматические углеводороды:
Реакция Дюма
Нагревание смеси соли карбоновой кислоты и гидроксида Na, при котором происходит отщепление группы COONa от молекулы соли:
C2H5COONa (пропионат натрия, тв.) + NaOH(тв.) = CH4 (метан) + Na2CO3;
CH3COONa (ацетат натрия, тв.) + NaOH(тв.) = CH4 (метан) + Na2CO3.
Реакция Кольбе
Получение насыщенных углеводородов путём электролиза водных растворов калиевых или натриевых солей карбоновых кислот:
2CH3COONa (ацетат натрия) + 2H2O ==> 2СО2 + Н2 + CH3-CH3 (этан) + 2NaOH.
Синтез Густавсона
Результат отщепления двух атомов галогена от дигалогеналканов:
СlСН2-СН2-СН2-СН2Cl + Zn = C4H8 (циклобутан) + ZnCl2
Магний возможно заменять цинком.
Процесс получения бутадиена из этанола:
2C2Н5-OH = Н2 + 2Н2O + СН2 = CH-CH = СН2
Реакция Бутлерова
Процесс получения моносахаридов из формальдегида в слабощелочном водном растворе при наличии ионов металлов, к примеру кальция:
6НCНO = C6Н12O6
Реакция Коновалова
Механизм нитрования алифатического, алициклического и жирноароматического соединения разбавленного НNО3:
C2H6 + HNO3 = C2H5NO2 + Н2O.
Эффект Хараша
Процесс присоединения бромоводорода при наличии перекиси. Реакция проходит вопреки правилу Марковникова:
СН3-СН = СН2 + HBr = [Н2О2] => СН3-СН2-СН2Br.
Реакция Вагнера
Взаимодействие перманганата калия и холодного раствора воды – процесс мягкого окисления алкенов (образуется диол). Уравнение выглядит следующим образом:
3СН3-СН = СН2 + 2KMnO4 + 4H2O = 2MnO2 + 2KOH + 3СН3-СН(OH)-СН2(OH).
Реакция Кучерова
Механизм, при котором получаются карбонильные соединения из алкинов при наличии соли ртути (II) в кислой водной среде. В результате гидратации получается енол, изомеризующийся в разновидность альдегида или кетона.
C2H2 + H2O = CH3CHO.
Реакция Зелинского
Способ тримеризации ацетилена. Процесс проходит во время пропускания ацетилена над активированным углем. Получается раствор бензола:
3C2H2 = C6H6.
Реакция Зинина
Образование ароматического амина путем восстановления нитросоединений в растворах в щелочной и нейтральной среде:
R-NO2 + 3(NH4)2S = R-NH2 + 3S + 6NH3 +2H2O.
Реакция Фриделя-Крафтса
Процесс алкилирования или ацилирования ароматического соединения при наличии катализатора кислотного характера, минеральной кислоты, окислов, катионообменной смолы.
Агентами алкилирования являются алкилгалогенид, олефин, спирт, сложный эфир; ацилирования — карбоновая кислота, её галогенангидрид и ангидрид.
Общий вид процесса:
C₆H₆ + R-Hal = => C₆H₅-R + Hhal.
Получение бензола из циклогексана при температуре 420-480С:
C6H12
=> C6H6 + 3H2.
Реакция Прилежаева
Каталитическое окисление этилена с получением эпоксида. Автор реакции российский химик органик Н. А. Прилежаев.
Реакция происходит при температуре 200С:
2CH2
= CH2 + O2 => эпоксид этилена.
Обратимость химических реакций
Химические процессы могут протекать как в одну, так и в обе стороны. Последние называются обратимыми.
Чаще всего, в таких реакциях устанавливается равновесие – это значит, она идет с одинаковой скоростью в обоих направлениях. Зафиксировать тот или иной продукт становится сложно. В основном, направление процесса изменяется при повышении концентрации одного из реактивов.
Практически любая реакция, в которой не образуется окончательный продукт – газ, осадок или вода – являются обратимыми, так как ионы в растворе соединяются как в исходные молекулы, так и в продукты реакции с одинаковой скоростью. Зафиксировать образование одного из продуктов реакции не представляется возможным.
Обратимым реакциям можно задать определенное направление, используя катализаторы:
Например, в реакции получения аммиака из водорода и азота – 3H2 + N2 ⇌ 2NH3 –в качестве катализатора используют порошок железа, смещающего равновесие в сторону прямой реакции.
Для разных обратимых процессов характерны специфические катализаторы, ускоряющие прямой или обратный процесс.
Таблица. Условия протекания обратимых реакций
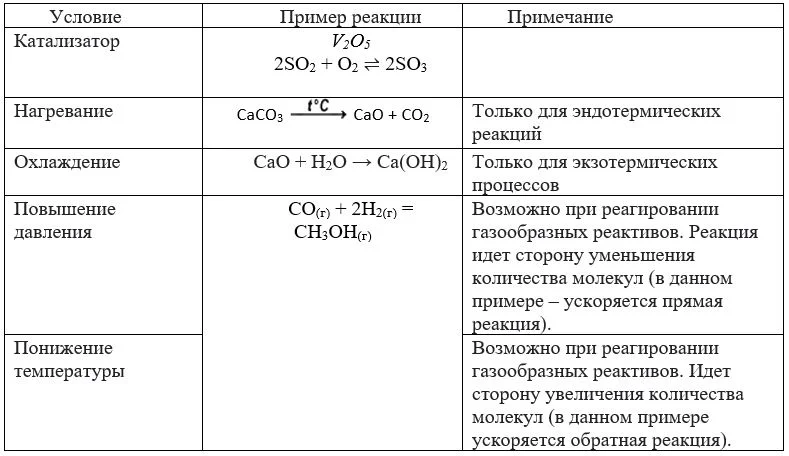
Изменение объема смеси взаимодействующих веществ не влияет на скорость, так как увеличение количества молекул не ускоряет их движение. А вот повышение чистоты реагентов может увеличить скорость реакции, так как увеличит вероятность столкновения нужных реагентов. Правда, в ряде случаев (серная и азотная кислота) изменение концентрации приводит к изменению состава продуктов.
Иногда, для течения реакции в определенно направлении нужно отводить продукт ее протекания: собирать осадок, газ или осаждать один из растворимых продуктов.
Таким образом, считается, что реакция идет, если мы можем увидеть или проверить с помощью специальных реактивов (индикаторов) образование новых продуктов. Если реакция идет в обоих направлениях, то она считается обратимой. В таком случае, ускорить ее в определенном направлении можно изменением условий (давление, температура, катализатор) или отведением одного из продуктов реакции.
2.Зачем нужен тест на антитела?
Тест на антитела может проводиться в следующих случаях:
Перед переливанием крови
Вы наверняка знаете, что у человека может быть одна из четырех групп крови. И антиглобулиновый тест можно проводить для определения возможности переливания крови. Если вам делают переливание, кровь донора должна соответствовать вашему типу (иметь одинаковые антигены). Если при переливании антигены отличаются, иммунная система разрушит перелитые клетки. Это может привести к серьезным заболеваниям и даже смерти. Именно поэтому поиск нужного типа крови является столь важным фактором.
Для выявления риска резус-сенсибилизации
Резус это антиген. Его полное название — резус-фактор. Тест Кумбса используется для обнаружения антител к резус-фактору в крови у беременных женщин. Если женщина с отрицательным резус-фактором крови беременна ребенком с положительным резус-фактором (он может передаваться от отца), есть риск наступления резус-сенсибилизации. Резус- сенсибилизация происходит, когда кровь ребенка смешивается с кровью матери во время беременности или родов. Если группа крови матери несовместима с группой крови ребенка, то ее иммунная система может атаковать плод, воспринимая его чужеродным объектом. При этом может развиться тяжелое заболевание, именуемое эритробластозой плода. В редких случаях, если заболевание не лечить, плод или новорожденный могут погибнуть.
Женщине с отрицательным резус-фактором крови могут провести инъекцию анти-Rh- гаммаглобулина (например, RhoGAM), используемого для предотвращения развития Rh- гемолитической болезни.
Для диагностики аутоиммунной гемолитической анемии
Аутоиммунная гемолитическая анемия является редким заболеванием, связанным с образованием антител к собственным антигенам эритроцитов.
Реакции одинарного замещения
В результате реакций одинарного замещения, более активный элемент замещает в соединении менее активный:
Zn(т) + CuSO4 (р-р) → ZnSO4 (р-р) + Cu(т)
Цинк в растворе сульфата меди вытесняет менее активную медь, в результате чего образуется раствор сульфата цинка.
Степень активности металлов по возрастанию активности:
- Au
- Ag
- Cu
- Pb
- Sn
- Ni
- Fe
- Cr
- Al
- Наиболее активными являются щелочные и щелочноземельные металлы
Ионное уравнение вышеприведенной реакции будет иметь вид:
Zn(т) + Cu2+ + SO42- → Zn2+ + SO42- + Cu(т)
Ионная связь CuSO4 при растворении в воде распадается на катион меди (заряд 2+) и анион сульфата (заряд 2-). В результате реакции замещения образуется катион цинка ( который имеет такой же заряд, как и катион меди: 2-)
Обратите внимание, что анион сульфата присутствует в обеих частях уравнения, т.е., по всем правилам математики его можно сократить. В итоге получится ионно-молекулярное уравнение:
Zn(т) + Cu2+ → Zn2+ + Cu(т)
Признаки химической реакции
Признак химической реакции – видимое изменение в реакционной смеси, по которому мы можем определить, что реакция прошла.
Такие признаки могут быть видны сразу:
- Выделение газа;
- Выпадение осадка;
- Растворение осадка
- Изменение цвета;
- Свечение;
- Появление специфического запаха
Иногда, констатировать процесс реакции можно только с использованием дополнительных реактивов:
- Изменение кислотности раствора;
- Образование продукта, вступающего в специфическую реакцию с видимыми изменениями характеристик реакционной смеси.
Выделение газа
Выделение газа происходит при образовании газообразного продукта или слабого электролита, распадающегося с выделением газа. Основной сложностью является идентификация образовавшегося продукта. Для каждого вещества существуют специфические признаки, идентифицирующие его.
Таблица. Газ и методы его определения
Выпадение осадка
Запомнить в какой реакции произойдет выпадение осадка не нужно. Это можно определить по таблице растворимости.
Осадки разных соединений отличаются по цвету и размеру кристаллов. Многие соединения имеют белый цвет:
- Карбонат кальция (растворим в кислотах);
- Сульфат бария (мелкокристаллический, нерастворим в кислотах);
- Гидроксид магния (аморфный);
- Гидроксид алюминия (студенистый);
- Гидроксид цинка (растворим в избытке щелочи);
- Фосфат кальция;
- Кремниевая кислота (коллоидная масса).
Ряд солей имеют желтый цвет:
- Бромид серебра (светло-желтый);
- Сульфат кадмия;
- Фосфат серебра.
Ярко-красное окрашивание характерно для гесацианоферрата калия, а гексацианоферрат железа – синий.
Сульфаты большинства металлов черного цвета.
Свечение
Люминесценция – редки признак химической реакции. Это часто наблюдается в живой природе у растений (в процессе фотосинтеза) и животных (светлячки).
К химии это можно наблюдать при использовании специального вещества – люминола. Такие реакции широко распространены в криминалистике, так как люминол очень чувствителен к органическим веществам. Причем, по цвету и степени свечения можно определить примерный состав и время оставления обнаруженного следа.
Появление специфического запаха
Запах можно почувствовать при образовании газов. Основные газы? из них – аммиак и оксид серы (IV). Такие вещества ядовиты, поэтому их идентификация без соблюдения техники безопасности может привести к отравлению и ожогу слизистой носа.
Изменение кислотности раствора
В реакции может происходить образование кислот, оснований или солей. Изменение кислотности можно определить добавив индикатор. В химии используются три основные индикатора: фенолфталеин, метилоранж, лакмус.
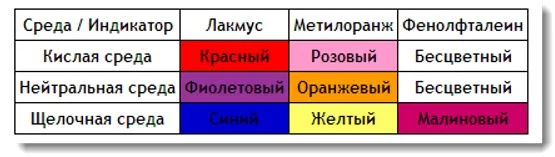
Для определения щелочи лучше всего использовать фенолфталеин, так как он меняет цвет только в этой среде. Самым неудобным индикатором для определения кислотности среды является метилоранж, так как различить в реальности оранжевый и желтый бывает сложно.
Кроме растворов индикаторов можно использовать индикаторную бумагу: она может быть пропитана одним индикатором или всеми одновременно. Последняя называется универсальной. С помощью такой бумаги можно определить не только среду – кислая, щелочная или нейтральная, но и более точное значение pH. Такая бумага очень чувствительна. Вместе с ней предоставляется шкала изменения цвета и соответствующие значения pH.
У индикаторной бумаги разных марок шаг чувствительности разный и варьирует от единиц до сотых.
В медицине определение кислотности имеет важное значение, так как многие процессы идут при определенной кислотности. Так, в ротовой полости среда щелочная и фермент слюны – амилаза – работает только в такой среде
В желудке среда кислая, что важно для пищеварительных ферментов желудка. При различных заболеваниях или вредных привычках может изменяться параметр кислотности, что служит важным диагностическим признаком.
3.Типы антиглобулиновой пробы
Существуют два типа антиглобулиновой пробы, или реакции Кумбса: прямой и непрямой.
Прямая реакция Кумбса, или прямой антиглобулиновый тест обнаруживает антитела, связанные с эритроцитами. Он используется для определения анемии. При этой болезни эритроциты разрушаются быстрее, чем производятся.
Непрямая реакция Кумбса, или непрямой антиглобулиновый тест проводится для поиска антител, не связанных с эритроцитами. Для пробы используется сыворотка крови, в которой и находятся антитела. Эта процедура достаточно редкая: в основном ее проводят для определения возможности переливания крови или как этап обследования беременных женщин.
Основные понятия
Под химической реакцией понимают процесс превращения одних веществ в другие. При этом, происходит передача электронов или образование новых связей. Каждое химическое взаимодействие характеризуется специфическими параметрами, характеризующими сами реактивы, условия проведения и химические преобразования. От всех этих факторов зависит внешний вид реакционной массы.
- Вещества, которые вступают в химическую реакцию, называются исходными, а образующие в результате нее – продукты.
- Исходя из преобразований молекул выделяют типы химических реакций: соединение, расщепление, замещение, обмен. Есть более сложные варианты: полимеризация, комплексообразование, перенос.
- В любой реакции происходит изменение энергетических состояний молекул. В одних случаях требуется затрата энергии на разрыв молекулярных связей – эндотермические реакции, в других – энергия выделяется сама из-за ее высвобождения – экзотермические процессы.
- Вещества могут находиться в разных агрегатных состояниях – жидком, твердом, газообразном. Также, в процессе химического взаимодействия может происходить смена агрегатного состояния.
Все эти факторы формируют параметры химического процесса: признаки, скорость, обратимость и т.д.
Скорость химической реакции
Чтобы теоретически определить скорость химической реакции, нужно учесть условия ее протекания. При этом при гомогенном характере реакции (когда реагенты пребывают в одной фазе, в одном агрегатном состоянии) скорость определяется изменением концентрации вещества за единицу времени. Таким образом можно дать более точное определение скорости гомогенной реакции.
Математически это выражается с помощью уравнения:
v — скорость химической реакции
C — равновесная концентрация продукта реакции;
A — равновесная концентрация исходного вещества, знак минус в этой части уравнения появляется, поскольку концентрация исходных веществ уменьшается в ходе реакции, а скорость реакции — положительная величина;
t — время.
При гетерогенном характере (реагенты находятся в разных фазах, в разных агрегатных состояниях), в реакцию вступают только частицы, которые находятся в непосредственном контакте друг с другом, т.е. на поверхности. Поэтому на скорость гетерогенной реакции большое влияние оказывает площадь соприкосновения веществ.
Химия — это просто
- Популярно о химии
-
· Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
- Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
-
· Виды химических реакций
· Уравнения химических реакций
· Классификации химических реакций
· Баланс химических реакций
· Химическое равновесие
· Скорость химических реакций
· Окислительно-восстановительные реакции
· Составление уравнений ОВР
· Тепловой эффект реакции
· Закон Гесса
· Электрохимические элементы
· Кислоты и основания
· Сильные кислоты и основания
· Слабые кислоты и основания
· Кислотно-основные реакции
· Индикаторы
· Водородный показатель pH - НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ
Серологические реакции
В лабораторной практике используют серологические реакции — лабораторные реакции между антигенами и антителами, которые приводят к регистрируемым изменениям в исследуемой системе. Эти реакции получили название серологических, так как для их постановки используют сыворотку (serum), содержащую антитела.
Серологические исследования, выполняемые для обнаружения специфических антител и антигена возбудителя при инфекционных заболеваниях, — более доступные методы лабораторной диагностики, чем бактериологическое выявление возбудителя. В ряде случаев серологические исследования остаются единственным методом диагностики инфекционных заболеваний.
Классификация химических реакций
На рисунке видно, что классификация химических реакций составлена на основании конкретных признаков. Так, по числу вступивших в реакцию и образовавшихся веществ они бывают реакциями соединения, разложения, замещения и обмена. Реакции, в которых происходит изменение степеней окисления атомов элементов, называются окислительно-восстановительными. Реакции, протекающие без изменения степеней окисления, называются неокислительно-восстановительными.
В зависимости от того, идет ли реакция с выделением либо с поглощением энергии (тепла), существует деление на экзо- и эндотермические реакции.
В зависимости от участвующих компонентов, химические реакции могут иметь обратимый либо необратимый характер. Необратимые реакции протекают только в одном направлении, обратимые — в прямом и обратном направлении. При соответствующих условиях полученные вещества могут преобразоваться обратно, в первичные продукты. В отдельных случаях из двух растворенных веществ может синтезироваться нерастворимый продукт. Тогда реакция становится необратимой. Еще одним примером необратимого процесса является сгорание углеводородного топлива (в присутствии кислорода из атмосферы). В результате него выделяется тепловая и световая энергия, а также образуется углекислый газ и H2O.
По наличию катализатора (вещества, которое изменяет скорость реакции, но при этом само не расходуется), реакции делятся на каталитические и некаталитические.
Рассмотрим более детально деление реакций по числу и составу веществ, вступающих во взаимодействие и получившихся в результате него:
По изменению степеней окисления реакции бывают: 1. С изменением степени окисления (происходит переход электронов от одного атома к другому):
H2S-2+O20 →S+H2O-2
2. Без изменения степени окисления. В этом случае каждый атом в конце реакции имеет ту же степень окисления, что и в начале:
H2SO4+NaOH→NaHSO4+H2O
Характеристика по тепловому эффекту:
Реакция с поглощением тепла (эндотермическая реакция):
N2+O2→2NO-90,4 кДж
В ходе данного взаимодействия поглощается 90,4 кДж тепла. -90,4 кДж — тепловой эффект реакции.
Реакция с выделением тепла (экзотермическая реакция):
H2+Cl2→2HCl+92,3 кДж
В этой реакции выделяется 92,3 кДж тепла.
Следующим важным принципом классификации является критерий обратимости либо необратимости взаимодействия. Рассмотрим таблицу:
В уравнениях необратимых реакций используют стрелку →, для обратимых .
В химии существует ряд условий, при наличии которых реакция считается необратимой. Они отражены в таблице:
В случае обратимых реакций под воздействием внешних факторов (изменение концентрации веществ, температуры, давления) соотношение скоростей прямой и обратной реакций могут изменяться. Если скорость прямой реакции выше, чем обратной, в реакционной системе преобладают продукты реакции. В этом случае говорят, что равновесие смещено в сторону прямой реакции (вправо). Если скорость обратной реакции выше, и в системе преобладают исходные вещества, говорят, что равновесие смещено в сторону обратной реакции (влево). Факторы, влияющие на положение равновесия, перечислены в таблице.
Широко распространены реакции, которые с заметной скоростью протекают только в присутствии катализаторов — каталитические реакции. Большинство реакций, протекающих в живых организмах, происходят с участием ферментов (природных катализаторов). Используемая в гигиенических и санитарных мероприятиях перекись водорода (в концентрации 3%) является относительно устойчивым веществом. Однако при контакте с MnO2 распадается на воду и кислород. В данном примере диоксид марганца является катализатором химической реакции разложения пероксида водорода.
Реакции двойного замещения
В реакциях двойного замещения происходит замещение уже двух электронов. Такие реакции еще называют реакциями обмена. Такие реакции проходят в растворе с образованием:
- нерастворимого твердого вещества (реакции осаждения);
- воды (реакции нейтрализации).
Реакции осаждения
При смешивании раствора нитрата серебра (соль) с раствором хлорида натрия образуется хлорид серебра:
Молекулярное уравнение: KCl(р-р) + AgNO3 (p-p) → AgCl(т) + KNO3 (p-p)
Ионное уравнение: K+ + Cl- + Ag+ + NO3— → AgCl(т) + K+ + NO3—
Молекулярно-ионное уравнение:
Cl- + Ag+ → AgCl(т)
Если соединение растворимое, оно будет находиться в растворе в ионном виде. Если соединение нерастворимое, оно будет осаждаться, образовывая твердое вещество.
Растворимые ионные соединения:
|
Нерастворимые ионные соединения:
|
Реакции нейтрализации
Это реакции взаимодействия кислот и оснований, в результате которых образуются молекулы воды.
Например, реакция смешивания раствора серной кислоты и раствора гидроксида натрия (щелока):
Молекулярное уравнение:
H2SO4 (p-p) + 2NaOH(p-p) → Na2SO4 (p-p) + 2H2O(ж)
Ионное уравнение:
2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O(ж)
Молекулярно-ионное уравнение:2H+ + 2OH- → 2H2O(ж) или H+ + OH- → H2O(ж)
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном. По фазовому состоянию разделяют реакции гомогенные и гетерогенные.
Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
Например, окисление сернистого газа:
2SO2(г) + O2(г) = 2SO3(г)
Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например, взаимодействие углекислого газа и гидроксида кальция:
CO2(г) + Ca(OH)2(р-р) = CaCO3(тв) + H2O
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества
Например, получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
CH4(г) + H2O(г) = CO(г) + 3H2(г)
Таким образом, паровая конверсия метана — гомогенная реакция.






























